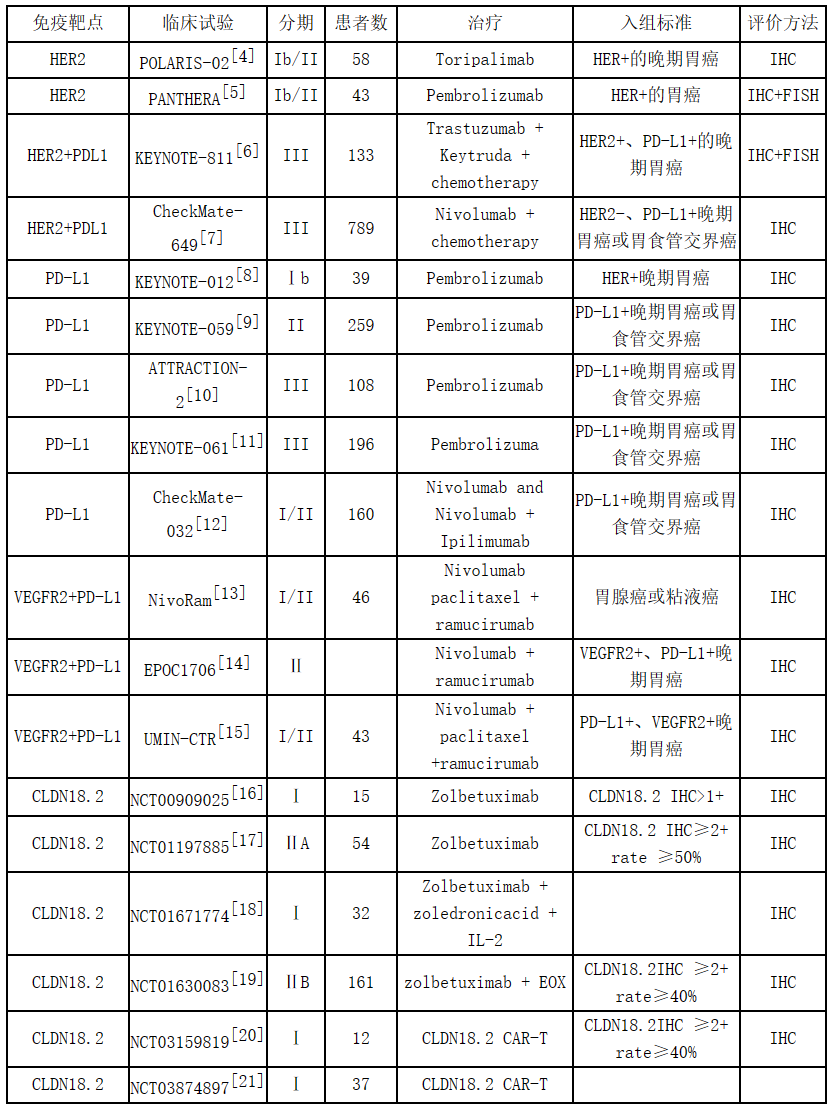
2022年11月17日,日本astellas公司发布新闻,宣布CLDN18.2药物与mFOLFOX6联用用于晚期或转移型胃癌和胃食管结合癌一线用药的Ⅲ期临床实验获得成功。

CLDN18.2新闻(来自astellas官网)
该临床试验的入组人群是HER2阴性且CLDN18.2阳性胃癌患者。参照当前多个临床实验汇总的数据,四成以上的晚期胃癌人群可以使用CLDN18.2药物,远远超过目前批准使用率最高的HER2药物(8-30%)。因此该消息在胃癌靶向用药方面可谓是“重磅炸弹”。癌靶向药研究背景
CLDN18.2的前世今生——胃癌靶向药研究背景
说起靶向药,首先想到的是肺癌中的第一代神药——吉非替尼(商品名易瑞沙),用于靶向EGFR蛋白,对EGFR19del,EGFR21del,L858R均有效,用于晚期肺腺癌的治疗,2002年上市并在2年后进入中国市场(2016年专利到期后国内开始出现仿制药,现在的价格已成断崖式下降,易瑞沙3000 RMB/月,仿制药1000 RMB/月)。在胃癌中也有一个替尼药物:阿帕替尼,用于靶向VEGFR1、2、3、PDGFR-β、C-kit、FGFR1等蛋白。前期的思路还是以“万能钥匙”为目标,设计治疗方案针对一套靶点,早期开发的小分子药物由于分子量低,其特异性必定大打折扣,每个靶点都想结合,可能最终每个靶点结果效果都为一半。因此后续研究中更喜欢采用更大的分子来增强特异性并增强体内滞留时间,也就是说“一把钥匙开一把锁”。更重要的是以抗体为主的生物大分子药物意味着药企有更高的技术能力和专利壁垒,从而谋取更高的利润率。
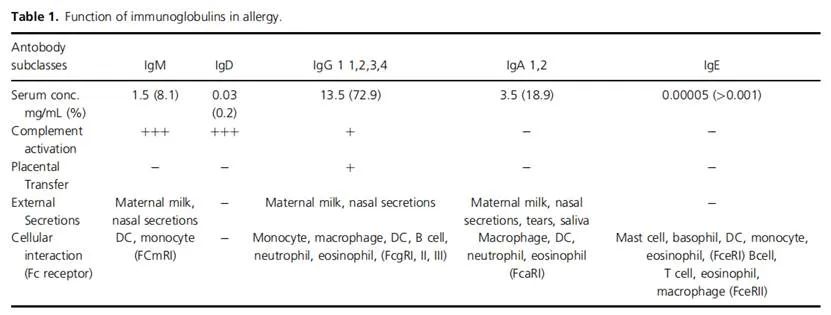
不同Ig亚型的能力[1]
不过后续抗体开发又开始以多靶点为目标,“天下大势,合久必分,分久必合”,当前肿瘤治疗中,新辅助治疗→手术→辅助治疗已成常态。既然两种抗体药物结合可以有效增强疗效,为什么不开发双头抗体呢?本着这个目的大量双抗处于研发阶段,CD3+万物的模式几乎适用于所有靶标,近年来4-1BB也开始崭露头角。但是双抗体的开发难度较高,且特异性和灵敏度会打折扣,目前的抗体市场还是以单克隆抗体为主。
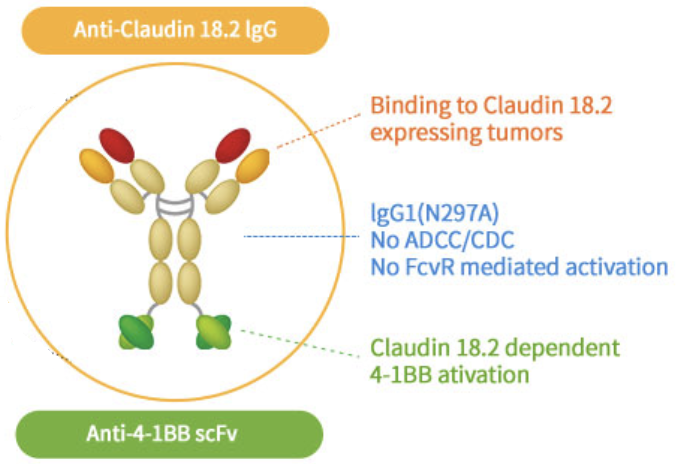
天境生物CLDN18.2/4-1bb双抗
常见治疗型抗体的功能无非就是两种:阻遏和杀伤,前者是将150kDa的大分子结合到蛋白上,使之失去原有蛋白的功能;后者通过抗体的ADCC和CDC效应最终让细胞死亡。目前以IgG1亚型为主的药物抗体大多兼具两者功能。近年来也有公司对Fc片段进行改造,在末端加入4-1BB因子来吸引APC细胞参与细胞免疫。
当前进展较好的靶点大多偏向于广谱分布于发病率高的肿瘤。肺癌+消化道癌+女性特异肿瘤+男性特异肿瘤必定是重点攻关区域。EGFR(HER1)、VEGF/VEGFR、HER2、AR均是各自适用肿瘤的佼佼者。毕其功于一役的重担便落到了PD1/PDL1身上,其他靶点像是特种部队,只杀目标人群;而这个靶点好比人民警察,只要发现有风险就会前往处理(当然这里面也有很多问题,多数肿瘤中PDL1表达率很低,导致这个神药使用率很低)。如果说2000年肿瘤我们还在以“与瘤共存”为目标,20年后我们的目标变成了“长期治愈”,可见新世纪初肿瘤学取得了多么令人瞩目的进步。
胃+胃食管结合癌?
我们的胃作为消化道中的重要一环,上接食管,下连十二指肠,但是十二指肠癌发病率极低(消化道癌的0.35%),因此食管、胃、肠、肝、胰腺成为研究重点。食管和胃连接处有齿状线,齿状线来源是因为线上下的组织来源不同,简单来说齿状线区域属于两种来源的组织混合区,齿状线以上是食管源性,齿状线以下是胃源性。按照德国学者Siewert的定义,齿状线上下5cm的区域均属胃食管结合癌,偏上的区域按照食管癌治疗,中央和偏下区域按照胃癌治疗。
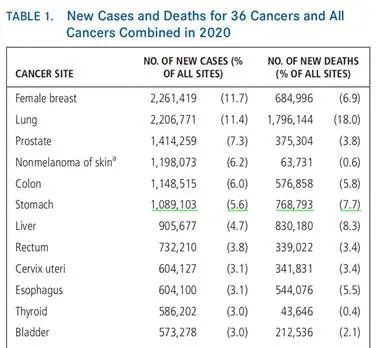
全球2020年癌症统计[2]
从当前全球流行病学的数据来看,发病人数109万(所有癌种中占比第6),而死亡人数77万(所有癌种中占比第3)。但是,这里一半的发病人数和死亡人数都是中国贡献的[3]。也就是说中国的胃癌人群占全球第一。从数据来看胃癌有两个特征:发病高、更难治。
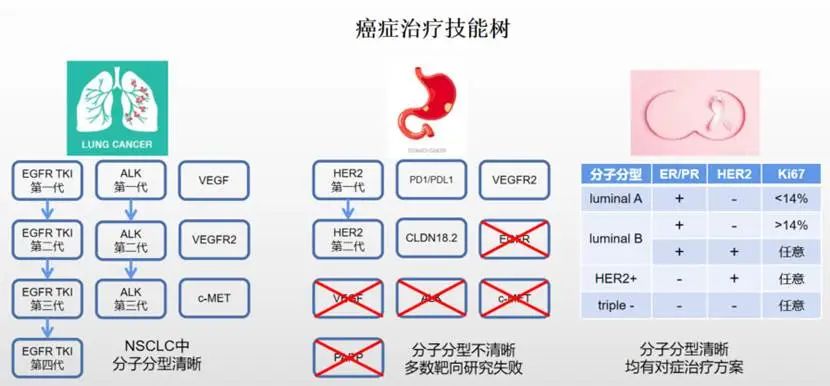
近年来全球花费大量资源用于胃癌治疗,但发现收益和付出不成正比。比如非小细胞肺癌NSCLC和乳腺癌BC的药物研究已成体系化、代次化发展,但在胃癌研究中还处于发现有效靶点的阶段。比如NSCLC EGFR基因有严格的大分类,每一种大分类都有对应的药物,随着治疗病程可能存在耐药和新突变,这时就可以按照指南更为对应药物。乳腺癌每种分型都有对应的治疗方案(当然每种分型下的生存期不同),而胃癌目前还在靶点是否有效的论证中。
众多在实体瘤中药效较好的抗体,胃癌应用中折戟沉沙,连当今的神药——PD1/PDL1药物也是披荆斩棘,两大产品帕博利珠单抗(Keytruda,K药)和纳武利尤单抗(Opdivo,O药)。K药开局王炸,keynote-059实验发现检测效果很好,之后便是一路滑铁卢,keynote-061,keynote062实验接连失败,只能采用HER2联用的方案keynote-811实验,最终获得成功。而适应症中只是明确写明HER2阳性。反而O药暗渡陈仓,通过巧妙设计入组人群(TPS>1%的人群不足20%),Checkmate-649获取成功,使PD-1+化疗纳入晚期胃癌的一线治疗。
纵观胃癌靶向药的临床,Ⅲ期临床真是个坎。O药、K药、阿维单抗、Lynparza、帕妥珠单抗、TDM-1都是在临门一脚失败了,和今年世界杯沙特一样一样的很悲催。