转移是癌症死亡的主要原因,了解远处转移形成的分子机制对患者的治疗至关重要。上皮-间质转化(Epithelial-Mesenchymal Transition,EMT)这一现象自从被发现一直是学术界关注的一个问题,指的是上皮细胞转化为间质细胞的过程,既是胚胎发育过程中的重要细胞分化程序,也是肿瘤转移的关键事件。而2013年Science上发表的一篇文章认为乳腺癌患者的CTCs通过EMT增加转移和侵略性,并表示间质型CTC是疾病进展的重要biomarker[1]。这一研究结果使得一直占临床应用主流的上皮表型循环肿瘤细胞平台受到挑战,CTC是肿瘤转移的种子,到底是上皮型CTC预后差还是间质型CTC预后差?与之相应的问题就是:到底是应该富集计数上皮型CTC还是应该关注间质型CTC?一时间众说纷纭,流派分立。然而在2015年Nature 上连续两篇文章在实验上证明在乳腺癌和胰腺癌动物模型中,EMT虽然参与肿瘤化疗抵抗的产生,但对肿瘤转移并非必要条件[2,3]。

近日,上海市第一人民医院肿瘤中心王红霞团队联合德国著名的乳腺癌专家Olivier Gires教授在著名学术期刊《Science Advances》上发表了亮点文章,澄清了这一困扰学术界数年的EMT问题。该研究以充分的数据表明以上皮细胞表型(E和E/m)为主的CTC细胞亚型具有更强的转移和增殖能力,它们才是乳腺癌患者的远处转移及较差预后的生物标记物[4]。
肿瘤细胞发生EMT时,会从鹅卵石样外观的上皮细胞,变成纺锤形的间充质形态。同时,细胞上表面标识物的表型会随之不断变化,形成不同类别的肿瘤细胞:包括上皮型 (E)、上皮型为主/间质混合型 (E/m)、间质型为主/上皮混合型 (M/e)及间质型 (M)。肿瘤细胞浸润血管(intravasation)进入血液后即为CTC,CTC可从血管外渗(extravasation)并扩散到远处的部位,如肺、肝或骨髓,在这些部位它们被称为播散性肿瘤细胞 (disseminated tumor cells, DTCs),并进一步形成肿瘤转移灶。虽然有大量证据支持EMT作为系统性癌症和治疗耐药性的关键事件,但CTCs或DTCs的EMT表型转变对转移形成的实际贡献仍未完全阐明。
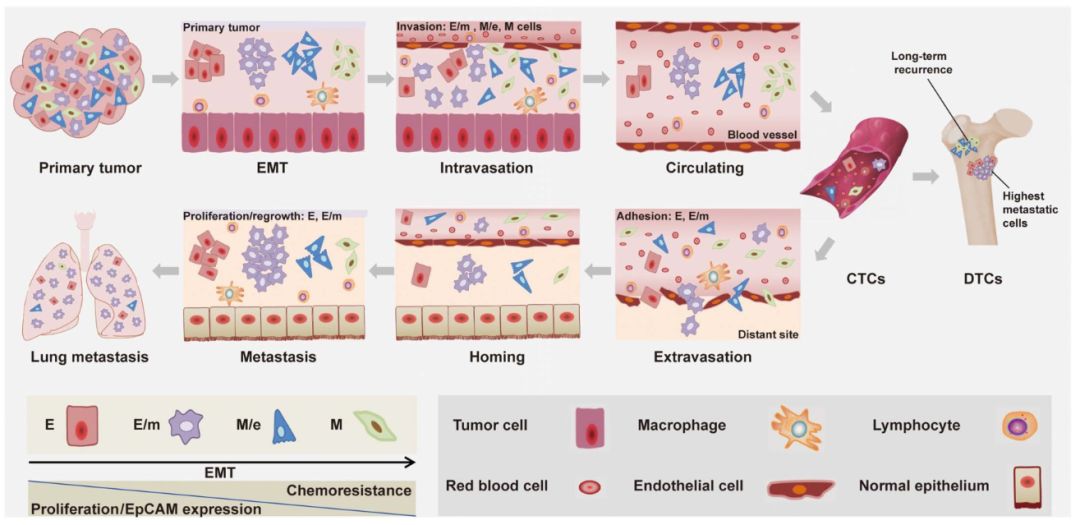
在此项研究中,研究人员借助同源移植技术,建立了4T1小鼠肿瘤动物模型,分离出血液CTCs和骨髓DTCs,并培养成相应细胞系CTC1和DTC1。将培养后的DTC1接种于BALB/c小鼠,成功分离培养26 个CTCs亚细胞系与10个DTCs亚细胞系,这些亚细胞系来自同一母代,但是涵盖了不同EMT表型的细胞亚型。
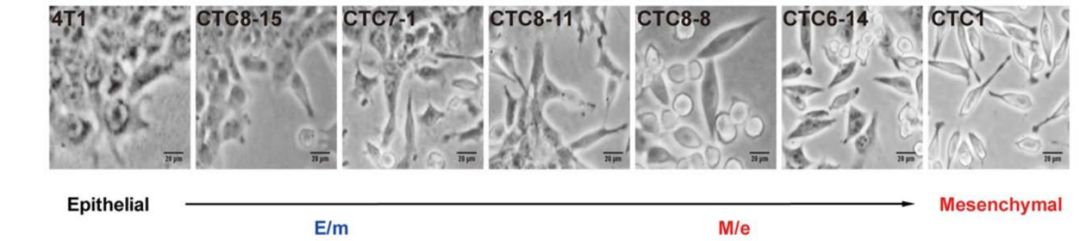
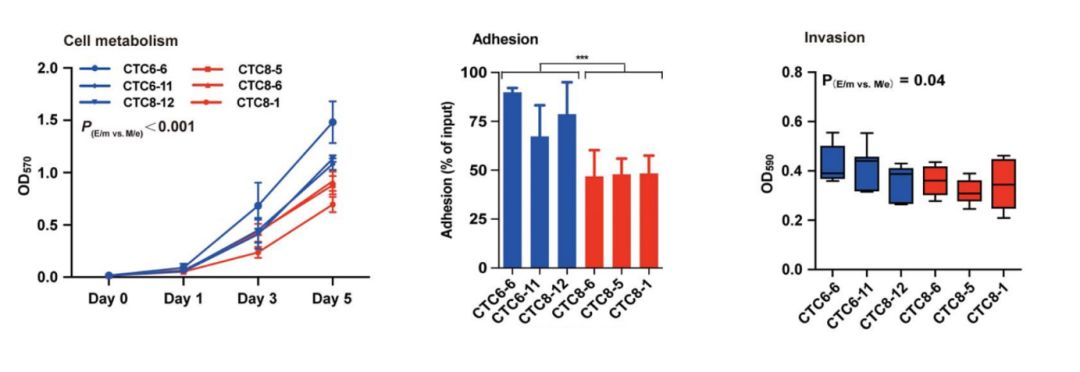
研究人员选择了E/m型(CTC6-6、CTC6-11和CTC8-12)和M/e型(CTC8-6、CTC8-5和CTC8-1)的CTC以及亲代4T1、CTC1和DTC1细胞,来判断EMT特征是否与不同的致瘤能力相关。结果显示,E/m组的细胞代谢和增殖率、对内皮细胞的粘附性、浸润能力均高于M/e组。
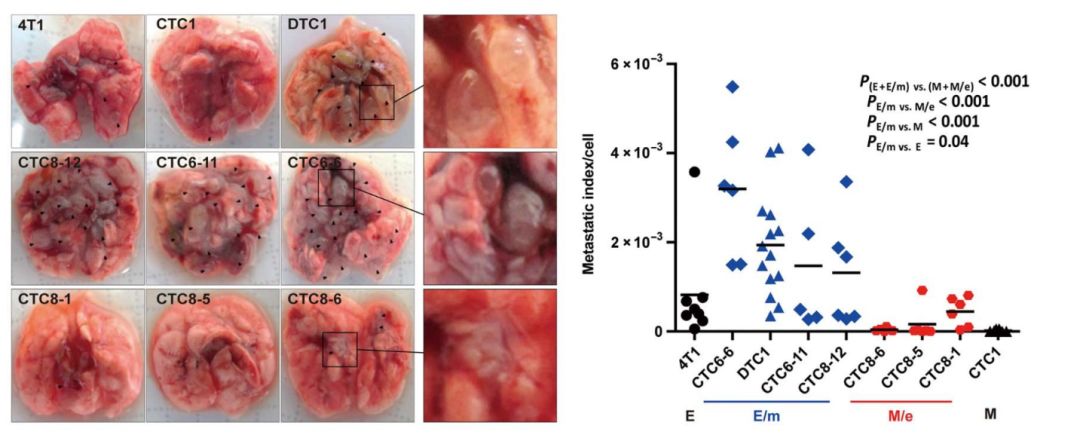
究竟哪种EMT表型的CTC是转移的“罪魁祸首”呢?为了探究谜底,研究人员将全部四种表型的CTC经静脉注射入BALB/c小鼠体内。结果表明,与间充质表型为主的细胞(M,M/e)相比,以上皮表型(E和E/m)为主的细胞亚型具有更强的转移成瘤能力。
研究人员接下来利用负性富集与免疫荧光-染色体原位杂交技术(SE-iFISH)对34例III期和IV期乳腺癌患者的CTCs和骨髓DTCs进行了染色体核型与EpCAM蛋白表型的同步原位检测。为了研究EpCAM+和EpCAM− CTCs在基因水平上的差异,研究人员又进行了单细胞DNA测序。结果显示,与患者各自的白细胞相比,两类细胞存在657个扩增或缺失的CNV差异,覆盖了1255个编码基因。其中,EpCAM+ CTCs扩增的基因涉及Tight junction(CLDN3, STRN, PTPN13), Mitotic cell cycle(CCNB1, SHB, EIF4EBP1, DUSP3, ABL1), Mammary gland epithelial cell differentiation(ERBB4)和Mammary gland duct morphogenesis(GLI2,CSF1R)等方面,提示了EpCAM+ CTCs的细胞粘附、增殖、上皮分化能力增强。
在接下来的研究中,研究人员评估了EpCAM表达水平是否与MBC患者的转移状态和疾病结局相关。发现EpCAM+ CTCs 、DTCs在各自总数中所占比例与患者肿瘤远端转移密切相关,尤其是EpCAM+ DTCs相关性更大。EpCAM+ DTCs所占比例可以准确预测MBC患者的6个月生存率和总生存率,以ROC曲线分析得到cut-off值为15%-20%,如果骨髓中EpCAM+ DTCs在DTCs总数中的比例大于cut-off值,患者的总生存率会显著降低。
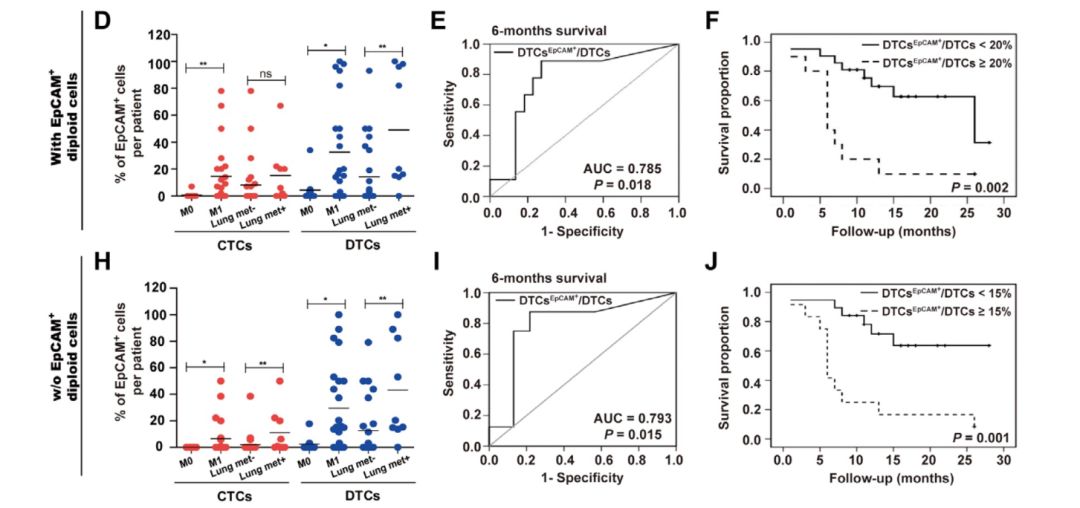
综上所述,此项研究从形态学、分子和表型分析揭示了CTCs的EMT异质性,证实了CTCs上EMT很少是一种“全或无”的状况,更多CTCs中上皮和间质特征共存,呈现高度异质性的混合型。CTCs和DTCs是转移起始细胞的主要来源,可以为临床提供肿瘤信息。同时研究人员在MBC小鼠模型和III期、IV期MBC患者的临床队列中证明,以上皮细胞表型为主的细胞亚型具有更强的转移潜能,上皮型细胞的比例与MBC患者的远处转移及较差预后显著相关。此外,此研究也提出依赖EpCAM的高灵敏度CTCs/DTCs富集检测系统通过量化临床上具有高转移潜能的这部分亚系细胞,可以更加准确预测乳腺癌患者的临床预后。
参考文献:
1. Yu M, Bardia A, Wittner BS, et al. Circulating breast tumor cells xxhibit dynamic changes in epithelial and mesenchymal composition. Science. 2013. doi: 10.1126/science.1228522.
2. Fischer KR, Durrans A, Lee S, et al. Epithelial-to-mesenchymal transition is not required for lung metastasis but contributes to chemoresistance. Nature. 2015. doi: : 10.1038/nature15748.
3. Zheng X, Carstens JL, Kim J, et al. Epithelial-to-mesenchymal transition is dispensable for metastasis but induces chemoresistance in pancreatic cancer. Nature. 2015. doi: 10.1038/nature16064.
4. Liu X, Li J, Cadiha BL, et al. Epithelial-type systemic breast carcinoma cells with a restricted mesenchymal transition are a major source of metastasis. Science Advances. 2019. doi: 10.1126/sciadv.aav4275.


